Lyson Macinnes, onderzoeker AMC Instituut te Amsterdam en coördinator EuroDBA
Marije Bartels, kinderhematoloog-oncoloog verbonden aan het UMC Utrecht
Juli 2017
Het wetenschappelijk onderzoek bij DBA is op alle fronten uitdagend. De onderliggende genetische defecten en de klachten die patiënten hebben zijn zeer wisselend.
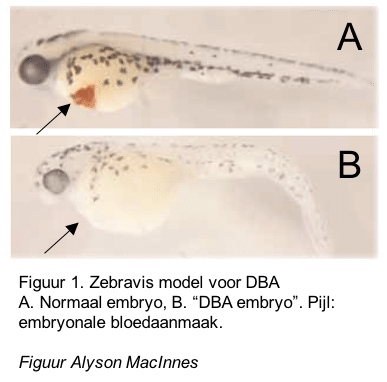
In het onderzoek wordt gebruik gemaakt van diverse diermodellen om DBA na te bootsen, onder andere in muizen en zebravissen (Figuur 1). Hiermee kun je specifieke kenmerken van de ziekte goed bestuderen, zoals de kwaliteit van de aanmaak van rode bloedcellen (erythropoiese) die bij DBA verstoord is, maar niet bij alle patiënten even ernstig is. Het nadeel van diermodellen is dat je de resultaten niet altijd rechtstreeks kunt vertalen naar de mens.
Er worden op dit moment veel studies gedaan waarbij wordt gekeken of er nieuwe werkzame stoffen (“compounds”) zijn die de aanmaak van voorlopers (proliferatie) van rode bloedcellen (erythrocyten) stimuleren. Een recent voorbeeld daarvan is een studie waarbij gebruik is gemaakt van zogenaamde programmeerbare stamcellen (iPSC). Dit zijn cellen afkomstig van bijvoorbeeld de huid (of ander orgaanweefsel) die ge(her)programmeerd worden in het celtype naar keuze, zoals rode bloedcellen.
In deze studie hebben ze iPSC afkomstig van DBA-patiënten laten uitgroeien tot voorlopers van rode bloedcellen en deze behandeld met diverse werkzame stoffen. Daarbij hebben ze geconstateerd dat de stof genaamd SMER28 de aanmaak van rode bloedcellen kan stimuleren. Dit hebben ze vervolgens getest in zebravissen (1). SMER28 is een activator van “autofagie”; een soort zelfbeschermingsmechanisme van cellen en een belangrijk proces tijdens de ontwikkeling van rode bloedcellen. In de toekomst kan de stof SMER28 mogelijk helpen bij de behandeling van DBA. Dit zal in de komende jaren verder moeten worden onderzocht.
Gentherapie
Daarnaast vinden er veel ontwikkelingen plaats op het gebied van gentherapie. Dit geldt voor DBA, maar ook allerlei andere genetische aandoeningen. Bij gentherapie wordt het defecte gen vervangen door een gezond gen. In het verleden werd in studies met name gebruik gemaakt van virussen om het defecte gen te vervangen. Vanwege de nadelige effecten hiervan (risico dat “foute” genen daarbij werden geraakt), wordt er de laatste jaren hard gewerkt aan alternatieven waarbij geen gebruik wordt gemaakt van virussen, maar van speciale eiwitten, de zogenaamde CRISPR-cas techniek.
Voor DBA zijn hier op korte termijn echter nog geen resultaten te verwachten. Doordat deze nieuwe eiwitten nu getest worden voor andere ziekten, kan dat nadat alles veilig is gebleken, op langere termijn deze techniek waarschijnlijk wel ook gebruikt gaan worden om DBA te genezen.
Op 25-11-2020 is er een online bijeenkomst geweest met medewerking van verschillende specialisten. Hierin werd ook aandacht gegeven aan gentherpie.
1. Doulatov et al. Drug discovery for Diamond-Blackfan anemia using reprogrammed hematopoietic progenitors. Science Translational Medicine 2017; 9 (376): eaah5645.
2. Jung et al. Modeling Human Bone Marrow Failure Syndromes Using Pluripotent Stem Cells and Genome Engineering. Mol Ther. 2015 Dec;23(12):1832.